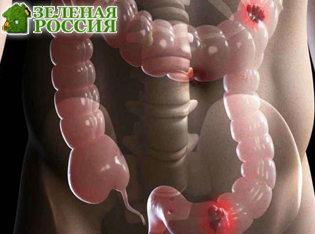
Учёные создали штамм бактерий Salmonella, который самоуничтожается внутри опухоли, высвобождая сигналы для активации иммунных «узлов» и сокращая рак толстой кишки у мышей. Это открывает путь к созданию «живых лекарств» против смертельно опасных онкологических заболеваний.
Колоректальный рак остаётся одним из самых смертельных видов рака в мире, а современные методы иммунотерапии далеко не всегда эффективны. В поисках новых решений исследователи из Медицинской школы Йонг Лу Лин Национального университета Сингапура (NUS Medicine) и Центрального Южного университета в Китае изучили способ усилить образование особых иммунных скоплений — зрелых третичных лимфоидных структур (mTLS), которые формируются рядом с опухолями и связаны с улучшением выживаемости.
«Наша работа даёт убедительные доказательства того, что mTLS можно стимулировать терапевтически с помощью синтетических биотиков», — объясняет соавтор исследования Сяоюань (Шон) Чэнь, профессор медицины и технологий и директор Программы трансляционных исследований в наномедицине NUS. — «Инженерный штамм активирует ключевой сигнальный путь LIGHT-HVEM, который запускает работу врождённых лимфоидных клеток 3-го типа и стимулирует противоопухолевый иммунный ответ Т-клеток».
Как это работаетИсследователи взяли ослабленный штамм Salmonella typhimurium, ранее признанный безопасным в клинических испытаниях при других видах рака. Эти бактерии естественным образом накапливаются в опухолях. Им добавили так называемую «схему синхронного лизиса» (SLC), благодаря которой они одновременно разрушаются при достижении высокой плотности внутри опухоли. В момент самоуничтожения бактерии выделяют белок LIGHT, который связывается с рецептором HVEM на иммунных клетках и запускает мощную иммунную активацию.
Терапию испытали на двух моделях мышей, предрасположенных к колоректальному раку: генетической (грызуны сами развивают опухоли) и химической (рак индуцирован). Учёные отслеживали изменения в иммунных клетках, включая ILC3, Т-клетки и появление mTLS.
Обычно развитие колоректального рака приводит к снижению защитных ILC3 и превращению их в менее полезные ILC1. Новый метод, напротив, увеличивал количество ILC3 и уменьшал ILC1. Более того, если обычная S. typhimurium могла запускать образование TLS, но не доводила их до зрелости, то бактерии, выделяющие LIGHT, создавали полноценные mTLS — с организованными зонами B- и T-клеток, что свидетельствует о формировании эффективных иммунных ниш.
РезультатыТерапия усиливала иммунный ответ: CD8+ Т-клетки становились активнее, выделяли интерферон-γ (IFN-γ), который стимулирует защитные реакции, и гранзим B, напрямую вызывающий гибель раковых клеток. Рост опухолей значительно снижался, выживаемость улучшалась, а у некоторых мышей рак полностью контролировался. При этом эффект зависел от пути LIGHT-HVEM и присутствия ILC3 — без них терапия не срабатывала.
Ограничения и перспективыИсследование пока ограничено моделями на мышах — человеческая иммунная система и микробиота могут реагировать иначе. Кроме того, бактерии при лизисе выделяют множество факторов, поэтому не всегда ясно, какие именно эффекты связаны именно с LIGHT. Сохраняются и риски: непреднамеренные инфекции, воспаления или непредсказуемые взаимодействия с микробиотой пациента.
Тем не менее, если результаты удастся перенести на людей, подход может стать новым направлением терапии: живые бактерии, нацеленные на опухоль, будут доставлять иммунные молекулы прямо на место болезни. Такая стратегия может дополнять ингибиторы контрольных точек или вакцины от рака, делая опухоли более заметными для иммунной системы.
«Этот подход может открыть путь к созданию программируемых “живых лекарств”, которые перестраивают опухолевую среду изнутри», — отметил Пэнфэй Жун, соавтор исследования из Третьей больницы Сянъя Центрального Южного университета.


 Учёные создали штамм бактерий Salmonella, который самоуничтожается внутри опухоли, высвобождая сигналы для активации иммунных «узлов» и сокращая рак толстой кишки у мышей. Это открывает путь к созданию «живых лекарств» против смертельно опасных онкологических заболеваний.
Учёные создали штамм бактерий Salmonella, который самоуничтожается внутри опухоли, высвобождая сигналы для активации иммунных «узлов» и сокращая рак толстой кишки у мышей. Это открывает путь к созданию «живых лекарств» против смертельно опасных онкологических заболеваний.

 Паховая грыжа – это довольно распространенное заболевание среди взрослых, но встречается и у детей. Это заболевание представляет собой ...
Паховая грыжа – это довольно распространенное заболевание среди взрослых, но встречается и у детей. Это заболевание представляет собой ... Покалывание в левой руке часто вызвано повреждением местных нервов или кровеносных сосудов. Оценка серьезности других симптомов поможет ...
Покалывание в левой руке часто вызвано повреждением местных нервов или кровеносных сосудов. Оценка серьезности других симптомов поможет ... Уличное освещение в значительной степени меняет экологию жуков и беспозвоночных, живущих в земле, как показало новое исследование. Ученые ...
Уличное освещение в значительной степени меняет экологию жуков и беспозвоночных, живущих в земле, как показало новое исследование. Ученые ...